А.П.Томилов
Историческая справка. Русский академик В.В.Петров в
1802 году (за 30 лет до открытия М.Фарадеем законов электролиза) с помощью созданной
им высоковольтной гальванической батареи обнаружил, что выделение электролизных
газов у электродов сопровождается подкислением воды у анода и подщелачиванием
у катода. Разделив пространство между анодом и катодом пористой диафрагмой,
В.В.Петров впервые получил воду, обогащенную продуктами преимущественно катодных
или преимущественно анодных электрохимических реакций — католит и анолит, соответственно.
В 1807 – 1808 гг. английским исследователем Г.Дэви с помощью
электролиза были получены неизвестные ранее металлы — натрий и калий, а позднее
электролиз был использован для получения магния и алюминия.
В 1837 году член Российской академии наук академик Б.С.Якоби
опубликовал сообщение о разработанном им методе гальванопластики – получении
металлических копий с рельефных изделий методом электролиза. Это открытие стало
основой промышленного рафинирования меди.
Первые электрохимические заводы для рафинирования меди были
построены в 70-х годах XIX века, после изобретения динамомашины. В 1886 – 1888
гг. возникли заводы для электролитического получения алюминия и хлорноватистокислых
солей. В 1890 г. введены в эксплуатацию заводы для электролитического получения
хлора, щелочи и металлического натрия, а затем для получения водорода и кислорода
электролизом воды, для получения электролитического никеля, меди, цинка.
В настоящее время электролиз водных растворов солей, электролиз
расплавов, производство аккумуляторов и гальванических батарей представляют
одну из крупнейших отраслей промышленности – электрохимическую. Задачи электрохимической
промышленности разнообразны. Наиболее важными из них являются:
- рафинирование цветных и благородных металлов;
- получение цветных металлов из руд;
- получение щелочных, щелочноземельных и других легких металлов;
- получение водорода, кислорода, хлора и щелочей;
- электролитический синтез неорганических и органических веществ;
- декоративные и антикоррозионные покрытия металлов;
- изготовление электрических аккумуляторов, гальванических элементов и других
химических источников электроэнергии; - электрохимическая размерная обработка металлов и сплавов.
Практически весь хлор (мировое производство около 50 млн. тонн
в год), почти весь гидроксид натрия, такие металлы как магний и алюминий, производятся
электрохимическим путем. Электрохимические процессы играют важную роль в металлургии
меди, цинка, кадмия, никеля, олова, натрия, бериллия, циркония, индия и в получении
ряда благородных металлов, в том числе золота.
Большинство важнейших современных электрохимических производств
представлено размещенными на большом пространстве в тысячи квадратных метров
многотонными электролизерами или гальваническими ваннами, связанными в единый
производственный комплекс сетью трубопроводов и электрических линий. Работа
этого комплекса обеспечивается целым рядом вспомогательных производств – для
очистки воды и приготовления исходных растворов, кондиционирования продуктов
электролиза, регенерации и нейтрализации отходов и др.
Что препятствовало открытию электрохимической активации?
Практически все растворы электролитов, применяемых в процессах прикладной электрохимии,
имеют высокую концентрацию и низкое удельное электрическое сопротивление, что
связано с требованиями минимизации расхода электроэнергии на единицу получаемого
продукта.
В связи с тем, что пресная вода или слабоминерализованные
исходные растворы не находили практического применения в прикладной электрохимии
в качестве растворов электролитов, то за более чем вековую историю ее развития
сформировалось представление о том, что электролиз пресной воды невозможен в
связи с малым количеством содержащихся в ней ионов. Это представление было основано
на традиционно сложившихся подходах к промышленным электрохимическим процессам,
для которых диапазон используемых напряжений на электродах единичной ячейки
обычно не превышал 6 вольт при силе тока в несколько сотен ампер.
На самом деле электролиз пресной, ультрапресной и даже
дистиллированной воды возможен, только для этого требуется высокое напряжение
между электродами, а сам процесс электролитического разложения воды протекает
при низкой плотности тока, т.е. с очень большими непроизводительными (с позиций
промышленного электролиза) затратами электроэнергии.
Как было обнаружено явление электрохимической активации?
В 1972 году инженер В.М.Бахир впервые обратил внимание на ранее неизвестный
факт: анолит и католит, полученные в диафрагменном электрохимическом реакторе
из слабоминерализованной воды, очень сильно отличаются по физико-химическим
параметрам и реакционной способности от моделей католита и анолита, приготовленных
путем растворения в воде химических реагентов, вид и количество которых определены
в соответствии с законами классического электролиза. Дальнейшие исследования
показали, что различия в свойствах только что полученных католита и анолита
разбавленных водно-солевых растворов от их химических моделей-аналогов (растворов
стабильных щелочей или кислот) не являются постоянными, стабильными во времени.
По прошествии некоторого времени (время релаксации) свойства и реакционная способность
анолита и католита, самопроизвольно изменяясь, становятся равными соответствующим
параметрам их химических моделей, т.е. в конечном итоге законы электролиза строго
выполняются, но не сразу, а лишь по прошествии достаточно длительного времени
— в общем случае от десятков минут до десятков и даже сотен часов.
Обнаруженные значительные различия в реакционной способности
и физико-химических параметрах дали В.М.Бахиру основание назвать анолит и католит
в период времени их релаксации активированными или, иначе, электрохимически
активированными растворами (водой) и сформулировать основные принципы технологии
электрохимической активации.
Электрохимическая активация: феномен и технология. Электрохимическая
активация как физико-химический процесс — это совокупность осуществляемых в
условиях минимального выделения тепла электрохимического и электрофизического
воздействий на воду с содержащимися в ней ионами и молекулами растворенных веществ
в области пространственного заряда у поверхности электрода (либо анода, либо
катода) электрохимической системы при неравновесном переносе заряда через границу
“электрод-электролит” электронами.
В результате электрохимической активации вода переходит в метастабильное
(активированное) состояние, которое характеризуется аномальными значениями физико-химических
параметров, в том числе окислительно-восстановительного потенциала, связанного
с активностью электронов в воде, электропроводности, рН и других параметров
и свойств. Самопроизвольно изменяясь во времени, возмущенные предшествующим
внешним воздействием параметры и свойства воды, постепенно достигают равновесных
значений в результате релаксации.
Процесс получения электрохимически активированных воды и растворов
относится к крайне неравновесным и является объектом изучения интенсивно развивающейся
новой области химии — синергетики в химических процессах и химической технологии.
Если в традиционной прикладной электрохимии основной задачей является отыскание
параметров оптимального приближения электрохимического процесса
к равновесным условиям, то для электрохимической активации важным является определение
параметров оптимального удаления от условий равновесного протекания
электрохимических реакций.
Электрохимическая активация как технология — это получение
и последующее использование электрохимически активированной воды либо в процессах
ее очистки от нежелательных компонентов, либо в различных технологических процессах
в качестве реагента или реакционной среды с целью управления сложными физико-химическими
реакциями, экономии энергии, времени и материалов, повышения качества конечного
продукта, уменьшения образования отходов.
Следует пояснить, что термин “вода” в приложении к процессам
электрохимической активации, обозначает разбавленный водный раствор электролитов
простого или сложного состава с общей концентрацией от нескольких миллиграммов
до нескольких граммов в одном литре. В общем случае, это и дистиллированная,
и ультрапресная, и пресная, в том числе питьевая, и слабоминерализованная (техническая)
вода, т.е. водные растворы электролитов, удельная электропроводность которых
значительно изменяется при относительно небольшом изменении концентрации. На
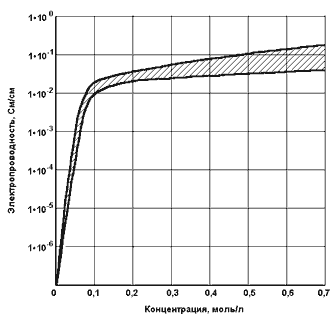
рис. 1 показана обобщенная зависимость удельной электропроводности большинства
неорганических электролитов — кислот, оснований, солей от их концентрации. Эффекты
электрохимической активации ярко проявляются для водных растворов, концентрация
электролитов в которых меньше 0,1 моль/л и существенно ослабевают в растворах,
концентрация электролитов в которых больше 0,1 моль/л.
Необходимо отметить, что, как правило, продукты реакций, полученные
с применением активированных растворов, не изменяют своих свойств и состояния
во времени, т.е. не подвержены процессам релаксации. Например, если при взаимодействии
воды с высоким содержанием ионов железа с активированным католитом в нерастворимые
соединения переводится в три раза больше ионов железа, чем при взаимодействии
той же воды с химической моделью католита, то результаты реакции необратимы
в обоих случаях.
Технические системы для электрохимической активации. В
общем случае, при пропускании постоянного электрического тока через воду на
электродах всегда происходят химические реакции и химический состав воды у анода
и катода изменяется. Задача электрохимической активации состоит в том, чтобы
подвергнуть всю жидкость воздействию электрического поля возможно более высокой
напряженности при максимально возможном химическом воздействии и минимальном
тепловыделении. Задача весьма непростая, поскольку в любых электрохимических
системах, представленных двумя электродами, погруженными в жидкость, наибольшая
интенсивность электрофизического воздействия может быть обеспечена только в
непосредственной близости к поверхности электрода, т.е. в области двойного электрического
слоя (ДЭС).
В связи с этим, для осуществления процессов электрохимической
активации необходимы специальные электрохимические реакторы, поскольку традиционные
электролизеры, как лабораторные, так и промышленные, сконструированные для оптимальной
реализации традиционных технологических процессов прикладной электрохимии, не
пригодны для работы на пресной воде или разбавленных водных растворах. Процесс
собственно активирования воды происходит только в непосредственной близости
к поверхности электрода, где напряженность электрического поля в двойном электрическом
слое (ДЭС) достигает сотен тысяч вольт на сантиметр.
ДЭС имеет очень малую толщину: в разбавленных растворах и
пресной воде — порядка 0,1 микрона, в концентрированных — намного меньше. Чтобы
яснее представить себе, насколько сложно обеспечить соприкосновение всех микрообъемов
воды, окружающей электрод, с его поверхностью, допустим, что в стакан погружен
электрод в виде металлического прутка диаметром с карандаш. Если допустить также,
что область высокой напряженности электрического поля вокруг электрода (область
ДЭС) вдруг увеличилась и достигла 1 мм, то, для сохранения пропорций системы,
диаметр стакана должен возрасти от 7 сантиметров до 700 метров. Понятно, что
обеспечить обработку всей воды этого “озера” у поверхности электрода невозможно,
не прибегая к специальным приемам.
Первые специальные технические средства для реализации ЭХА
(диафрагменные электрохимические реакторы) были разработаны в 1974 — 1975гг.
В.М.Бахиром и его коллегой Ю.Г.Задорожним. В течение почти 20 лет продолжалась
напряженная работа по созданию оптимальной конструкции реактора для электрохимической
обработки пресной воды и разбавленных водных растворов, которая в конце 80-х
— начале 90-х годов завершилась созданием принципиально новой конструкции —
проточного электрохимического модульного элемента ПЭМ-1. Но широкое коммерческое
использование технологических процессов с применением электрохимически активированных
растворов и воды стало возможным лишь в последние 7 — 8 лет благодаря появлению
промышленных электрохимических систем нового типа на основе проточных электрохимических
модульных элементов третьего поколения (ПЭМ-3, рис. 2.) и реакторов РПЭ в виде
блоков элементов ПЭМ-3 различной конфигурации, также созданных вышеназванными
изобретателями.
Отличия элемента ПЭМ от известных электрохимических реакторов
состоят в следующем:
- Элемент ПЭМ является модульным, имеет малые габариты и вес, в сочетании
с высокой производительностью и экономичностью, что позволяет использовать
его как в промышленных, так и в бытовых технических электрохимических системах. - Диафрагма элемента ПЭМ изготовлена из керамики на основе оксидов циркония
и алюминия и является очень прочной; она обладает малой фильтрационной способностью,
что исключает физическое смешивание катодных и анодных объемов воды, выдерживает
трансмембранный градиент давления до 1 атм. при сохранении постоянных размеров
электродных камер. - Диафрагма элемента ПЭМ обладает способностью к адсорбции на поверхности,
обращенной к аноду, частиц, заряженных положительно, а на поверхности, обращенной
к катоду — отрицательно заряженных частиц, что обусловливает снижение ее электрического
сопротивления в разбавленных водных растворах и пресной воде и тем самым снижает
расход электроэнергии, а также обеспечивает возможность длительной работы
при градиентах давления различных знаков между электродными камерами, что
позволяет использовать диафрагму как ионселективную перегородку в электрохимическом
реакторе.
- Электродные камеры элемента ПЭМ представляют собой кольцевые удлиненные
пространства между цилиндрическими поверхностями электродов и диафрагмы и
имеют соотношение размеров, которое позволяет обеспечить одинаковую среднюю
скорость движения микрообъемов жидкости в каждом из поперечных сечений, а
также создают условия для соприкосновения возможно большего количества микрообъемов
воды с поверхностью электрода, т.е. с областью ДЭС. - Оптимальное сочетание длины и ширины электродных камер в элементе ПЭМ гарантирует
отсутствие отрицательного влияния газонаполнения растворов в электродных камерах
на энергетические и функциональные характеристики элемента ПЭМ при высокой
плотности тока и малом протоке жидкости. - Элементы ПЭМ в устройствах для электрохимической обработки воды можно соединять
гидравлически не только параллельно, но и последовательно в единую гидравлическую
цепь без разрыва потока, что невозможно при использовании известных электрохимических
реакторов; при этом в цепь можно включать произвольно и в любом порядке как
анодные, так и катодные камеры различных элементов ПЭМ, помещая между ними
при необходимости вспомогательные устройства (флотационные, каталитические
реакторы, системы для регулирования давления, скорости, температуры потоков
и т.д.). - Элементы ПЭМ можно соединять электрически параллельно, последовательно или
последовательно-параллельно, что дает возможность не меняя гидравлическую
конфигурацию легко переходить при необходимости от схемы биполярного электролизера
к схеме монополярного или к схеме биполярно-монополярного электролизера.
В элементах ПЭМ создаются условия, при которых в течение
долей секунды большая часть микрообъемов воды подвергается обработке в поле
высокой напряженности ДЭС, что позволяет получать у анода воду с ярко выраженными
свойствами акцептора электронов (оксидантная вода), в то время, как у катода
образуется вода со свойствами донора электронов (антиоксидантная вода). И анолит
и католит являются разновидностями воды с повышенной электрической активностью,
которая проявляется в последующих физико-химических или биохимических реакциях
не только как самостоятельный фактор, но также как катализатор активности того
небольшого количества синтезированных в процессе электрохимического воздействия
продуктов анодных или катодных реакций.
Где электрохимическая активация используется сегодня?
С начала 90-х годов лидером в области исследований ЭХА и разработке различных
технологических процессов с использованием электрохимически активированных сред
является ОАО “НПО ЭКРАН” и ВНИИИМТ МЗ РФ. Этой же проблемой в сотрудничестве
с указанными организациями занимается ряд крупнейших научных учреждений России.
К настоящему моменту исследования феномена и технологий ЭХА имеют обширную географию,
включая США, Англию, Германию и ряд других стран.
Широкую известность в России и за рубежом получили установки
СТЭЛ, которые обеспечивают экологически чистыми стерилизующими и дезинфицирующими
растворами (анолитом типа АНК) медицинские и детские учреждения, предприятия
коммунального хозяйства, пищевой промышленности, плавательные бассейны.
В таблице 1 показаны сравнительные характеристики электрохимически
активированного анолита АНК, полученного в установках СТЭЛ и традиционных химических
препаратов для дезинфекции и стерилизации.
Таблица 1
Сравнение характеристик анолита АНК и различных дезинфицирующих
растворов
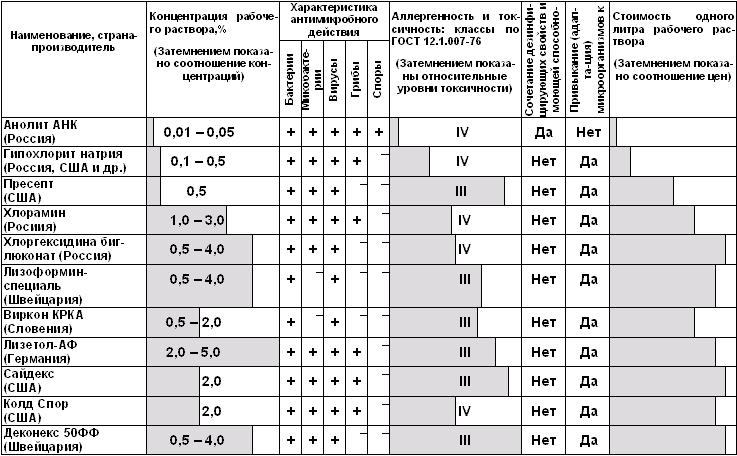
Одним из убедительных свидетельств преимущества электрохимически
активированного анолита АНК перед традиционными растворами дезинфектантов являются
результаты исследований, выполненных в мемориальном институте Battelle (США):
установлено, что споры сибирской язвы погибают в анолите АНК в течение нескольких
секунд, в то время как в растворе гипохлорита натрия с концентрацией действующего
вещества в 12 раз большей, чем в анолите АНК, тот же результат достигается лишь
через 30 минут.
Хорошо известны установки типа ИЗУМРУД различных модификаций,
снабжающие индивидуальных пользователей, детские учреждения, предприятия пищевой
промышленности и общественного питания обеззараженной и структурно улучшенной
питьевой водой, не уступающей по полезности родниковой и лучшим минеральным
водам. В таблице 2 приведены технические характеристики бытовых медицинских
установок ИЗУМРУД различных моделей, серийно выпускаемых в ОАО “НПО ЭКРАН”.
Данные установки имеют габариты 230х50х300 мм и вес около 1,9 кг при потребляемой
электрической мощности 30-60 Вт.
Таблица 2.
Показатели качества очистки воды в установках “Изумруд”.
|
Наименование загрязняющего компонента |
ПДК по данным ВОЗ |
Кратная ПДК концентрация загрязнений |
Степень очистки, % |
|
Общее микробное число, КОЕ/мл |
50 – 100 |
2 — 10 |
> 99,9 |
|
Коли-индекс, КОЕ/л |
3 |
~ 105 |
> 99,99 |
|
Вирус полиомелита , ед/мл |
— |
до 100 ед/мл |
> 99,99 |
|
Трихлорэтилен, мг/л |
0,005 |
до 20 |
70-80 |
|
Тетрахлорэтилен, мг/л |
0,005 |
10 |
89 |
|
Бензол, мг/л |
0,01 |
200 |
74 |
|
ПАВ, мг/л |
0,5 |
7 — 8 |
94 |
|
Пестициды(ДДТ), мг/л |
— |
до 10 мг/л |
90 |
|
Алюминий, мг/л |
0,5 |
2 8 > 10 |
63 75 97 |
|
Хром, мг/л |
0,05 |
1,5 10 > 100 |
70 95 > 99 |
|
Железо, мг/л |
0,3 |
3 5 10 |
70 – 80 85 95 |
|
Медь, мг/л |
1,0 |
3 – 4 20 — 30 |
84 от 80 до >99 |
|
Цинк, мг/л |
5,0 |
5 10 |
97 > 99 |
|
Мышьяк, мг/л |
0,05 |
3 – 3,5 |
90 |
|
Свинец, мг/л |
0,03 |
2,5 3,5 > 10 |
65 78 > 95 |
|
Фенол, мг/л |
0,001 |
6 10 — 20 > 100 |
85 50 – 70 80 — 96 |
|
Нитраты, мг/л |
10 |
2 3 -3,5 |
19 – 43 до 10 |
|
Нитриты, мг/л |
1,0 |
1,0 |
80 — 99 |
|
Тригалометаны, мг/л |
0,1 |
0,8 2 |
100 95 |
Дополнительные возможности технических систем для электрохимической
активации. Применение проточных электрохимических модульных элементов ПЭМ
для решения задач традиционных технологий прикладной электрохимии, позволило
создать принципиально новую технологию производства хлора на месте потребления.
Данная технология реализована в не имеющих аналогов в мире установках АКВАХЛОР.
Сущность процесса, реализованного в установках АКВАХЛОР заключается в том, что
в анодные камеры элементов ПЭМ под давлением 0,5 — 0,7 кгс/см2 медленно,
соразмерно скорости электрохимического превращения, вводят 10 — 20 %-ный раствор
хлорида натрия. Выделяющийся газообразный хлор удаляется через редуктор на нужды
потребителя, например, поступает в эжекторный смеситель и при растворении в
воде дает хлорную воду, которую далее используют для обеззараживания природной
пресной воды на водоочистных сооружениях или для обработки сточных вод, а католит,
образующийся при фильтрации воды и ионов натрия из анодной камеры в катодную
через пористую оксидно-циркониевую диафрагму под действием перепада давления,
используют в качестве моющего и очищающего агента или реагента-регулятора рН
в процессах коагуляционной очистки воды. Важно отметить, что расходные коэффициенты
по энергии и хлориду натрия в установке АКВАХЛОР весьма близки к теоретически
возможным значениям, что делает да
